Subtotal $0.00
pH एक रासायनिक अवधारणा है जो किसी घोल (solution) की अम्लता (acidity) या क्षारीयता (alkalinity) को मापने के लिए उपयोग की जाती है। यह घोल में मौजूद हाइड्रोजन आयनों (H⁺) की सांद्रता (concentration) पर आधारित होती है।
1. pH क्या है?
- pH का पूरा नाम “power of Hydrogen” या “potential of Hydrogen” है।
- यह एक संख्यात्मक स्केल है जो यह बताती है कि कोई घोल कितना अम्लीय (acidic), उदासीन (neutral), या क्षारीय (basic/alkaline) है।
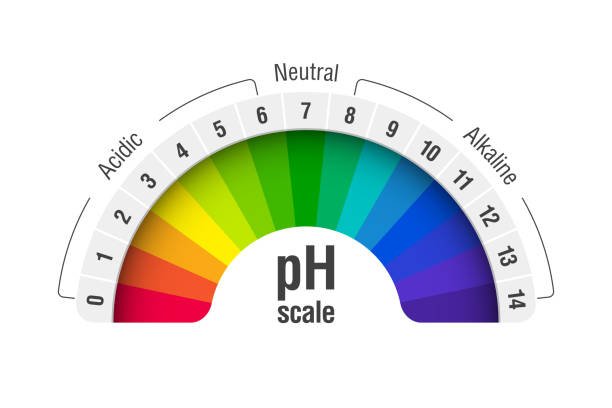
- pH स्केल 0 से 14 तक होती है:
- 0 से 6.9: अम्लीय (Acidic) – जितना कम pH, उतना अधिक अम्लीय।
- 7: उदासीन (Neutral) – न तो अम्लीय, न ही क्षारीय (जैसे शुद्ध पानी)।
- 7.1 से 14: क्षारीय (Alkaline) – जितना अधिक pH, उतना अधिक क्षारीय।
2. pH का वैज्ञानिक आधार
pH का संबंध घोल में हाइड्रोजन आयनों (H⁺) की सांद्रता से है। यह सांद्रता बहुत छोटी मात्रा में होती है, इसलिए इसे आसानी से समझने के लिए लघुगणक (logarithmic) स्केल का उपयोग किया जाता है।
गणितीय सूत्र:
pH = -log[H⁺]
- [H⁺]: घोल में हाइड्रोजन आयनों की सांद्रता (मोल प्रति लीटर में)।
- log: आधार 10 का लघुगणक (logarithm)।
- नकारात्मक चिह्न (-): सांद्रता को सकारात्मक और छोटी संख्या में बदलने के लिए।
उदाहरण:
- अगर किसी घोल में [H⁺] = 10⁻³ मोल/लीटर है, तो: pH = -log(10⁻³) = 3 (अम्लीय)
- अगर [H⁺] = 10⁻⁷ मोल/लीटर है, तो: pH = -log(10⁻⁷) = 7 (उदासीन)
नोट: pH स्केल लघुगणकीय है, यानी pH में 1 इकाई का अंतर [H⁺] सांद्रता में 10 गुना अंतर दर्शाता है। उदाहरण के लिए, pH 3 का घोल pH 4 के घोल से 10 गुना अधिक अम्लीय होता है।
3. अम्ल (Acids) और क्षार (Bases)
- अम्ल (Acids): ये ऐसे पदार्थ हैं जो पानी में घुलकर H⁺ आयन छोड़ते हैं। जैसे:
- नींबू का रस (साइट्रिक एसिड, pH ~2)
- सिरका (एसिटिक एसिड, pH ~2.5)
- हाइड्रोक्लोरिक एसिड (HCl, pH ~1)
- क्षार (Bases): ये ऐसे पदार्थ हैं जो पानी में घुलकर OH⁻ आयन (हाइड्रॉक्साइड आयन) छोड़ते हैं या H⁺ आयनों को ग्रहण करते हैं। जैसे:
- साबुन (pH ~9-10)
- बेकिंग सोडा (pH ~8.5)
- सोडियम हाइड्रॉक्साइड (NaOH, pH ~13)
उदासीनता (Neutrality): जब H⁺ और OH⁻ आयनों की सांद्रता बराबर होती है ([H⁺] = [OH⁻] = 10⁻⁷ मोल/लीटर), तब घोल उदासीन होता है, जैसे शुद्ध पानी (pH = 7)।
4. pH का मापन
pH को मापने के लिए निम्नलिखित तरीके उपयोग किए जाते हैं:
- pH मीटर: यह एक इलेक्ट्रॉनिक उपकरण है जो घोल में H⁺ आयनों की सांद्रता को मापकर सटीक pH मान देता है।
- pH पेपर/लिटमस पेपर: यह रासायनिक संकेतक (indicators) से बना होता है जो घोल के संपर्क में आने पर रंग बदलता है। रंग की तुलना चार्ट से करके pH अनुमानित किया जाता है।
- लाल लिटमस नीले में बदलता है: क्षारीय
- नीला लिटमस लाल में बदलता है: अम्लीय
- रासायनिक संकेतक (Indicators): जैसे फिनॉल्फ्थेलिन, मिथाइल ऑरेंज, जो विशिष्ट pH पर रंग बदलते हैं।
5. pH का महत्व
pH का उपयोग कई क्षेत्रों में महत्वपूर्ण है:
- रसायन विज्ञान: रासायनिक अभिक्रियाओं को समझने और नियंत्रित करने में।
- कृषि: मिट्टी का pH फसलों की वृद्धि को प्रभावित करता है। अधिकांश फसलें pH 6-7 के बीच अच्छी होती हैं।
- चिकित्सा: मानव शरीर में रक्त का pH ~7.4 होता है। थोड़ा सा भी बदलाव स्वास्थ्य समस्याएँ पैदा कर सकता है।
- उद्योग: खाद्य प्रसंस्करण, दवा निर्माण, और जल उपचार में pH नियंत्रण जरूरी है।
- पर्यावरण: नदियों और झीलों का pH जलीय जीवन को प्रभावित करता है। अम्लीय वर्षा (pH < 5.6) पर्यावरण को नुकसान पहुँचाती है।
6. pOH और इसका संबंध
pH के साथ-साथ pOH भी होता है, जो OH⁻ आयनों की सांद्रता को मापता है।
- pOH = -log[OH⁻]
- pH और pOH का योग हमेशा 14 होता है (25°C पर): pH + pOH = 14
उदाहरण: अगर pH = 3, तो pOH = 14 – 3 = 11
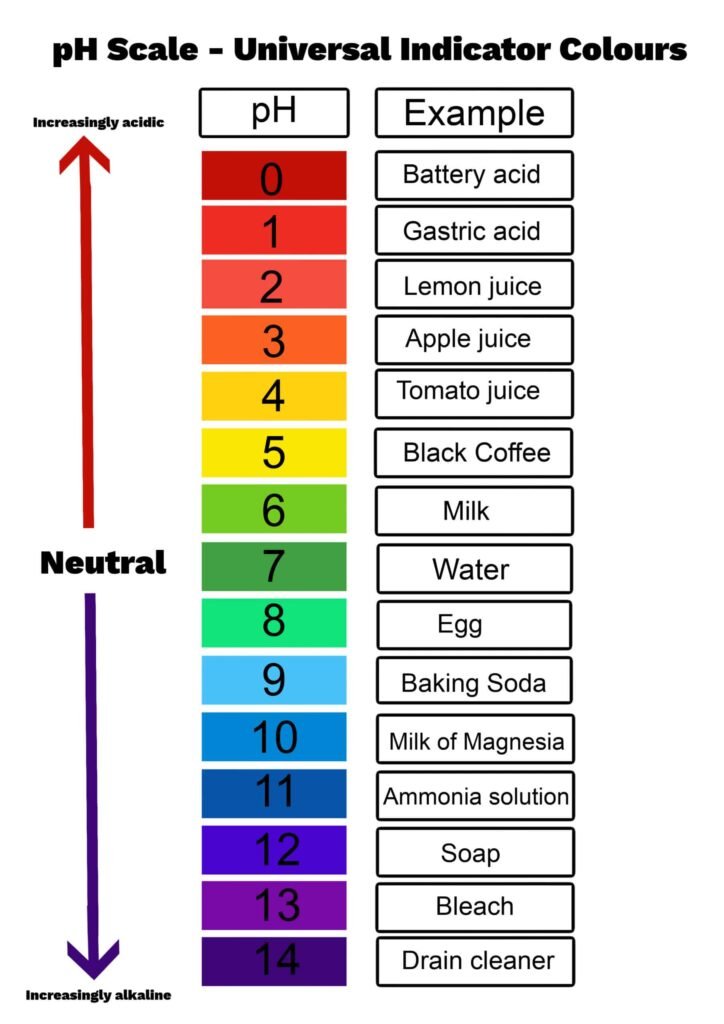
7. कुछ रोचक उदाहरण
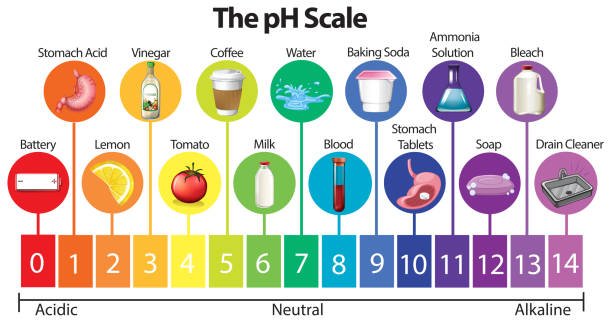
- बैटरी एसिड: pH ~0 (अत्यधिक अम्लीय)
- पेट का एसिड (HCl): pH ~1.5-3.5
- वर्षा का पानी: pH ~5.6 (हल्का अम्लीय, CO₂ के कारण)
- समुद्री पानी: pH ~8 (हल्का क्षारीय)
- ब्लीच: pH ~11 (अत्यधिक क्षारीय)
8. pH को प्रभावित करने वाले कारक
- तापमान: तापमान बढ़ने पर पानी का आयनन बदलता है, जिससे pH प्रभावित हो सकता है।
- अशुद्धियाँ: घोल में नमक, गैस, या अन्य रसायनों की मौजूदगी pH को बदल सकती है।
- बफर सिस्टम: कुछ घोल (जैसे रक्त) बफर सिस्टम के कारण pH को स्थिर रखते हैं, भले ही अम्ल या क्षार मिलाया जाए।
9. प्रयोगशाला में pH का उपयोग
- टाइट्रेशन: अम्ल-क्षार की सांद्रता जानने के लिए pH मापा जाता है।
- रासायनिक संश्लेषण: कई रासायनिक अभिक्रियाएँ विशिष्ट pH पर ही होती हैं।
- जैव रसायन: एंजाइम केवल विशिष्ट pH पर सक्रिय होते हैं।
10. दैनिक जीवन में pH
- खाना पकाने में: खमीर उठाने के लिए बेकिंग सोडा (क्षारीय) और सिरका (अम्लीय) का उपयोग।
- सौंदर्य प्रसाधन: शैंपू और साबुन का pH त्वचा के लिए उपयुक्त होना चाहिए (~5.5)।
- स्वास्थ्य: पेट में अम्लता की समस्या (हाइपरएसिडिटी) को कम करने के लिए एंटासिड (क्षारीय) लिए जाते हैं।
निष्कर्ष
pH एक साधारण लेकिन शक्तिशाली अवधारणा है जो रसायन विज्ञान, जीव विज्ञान, और दैनिक जीवन में महत्वपूर्ण भूमिका निभाती है। यह घोल की प्रकृति को समझने और नियंत्रित करने में मदद करती है।